Atomes et molécules
par administrateur · 4 janvier 2024

T.D. atomes et molécules en 3D avec MOLVIEW - 2023
Thème: Organisation et transformations de la matière
Compétences travaillées:
- D2 - Effectuer des recherches bibliographiques
- D1.3 - Lire, interpréter et produire des graphiques, diagrammes, tableaux ...
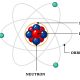
I. Atome
Les éléments chimiques, appelés les atomes, sont représentés par des symboles (C, H, O, N, Cl, S …): il en existe 94 naturels sur Terre.
Tous les atomes sont classés dans un tableau appelé, le tableau périodique des éléments ou encore tableau de Mendeleïev.
Par CC BY-SA 4.0, Lien
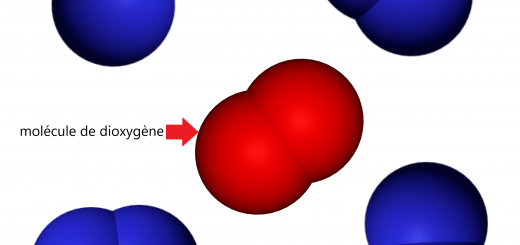
On représente les atomes par des sphères colorées.

II. Constitution des molécules
Une molécule est un assemblage d’atomes. Elle est représentée par une formule chimique qui indique le nom et le nombre des atomes qui la constituent.
Dans la formule chimique, le nombre d’atomes d’une même sorte est écrit en indice et à droite du symbole de l’atome correspondant.
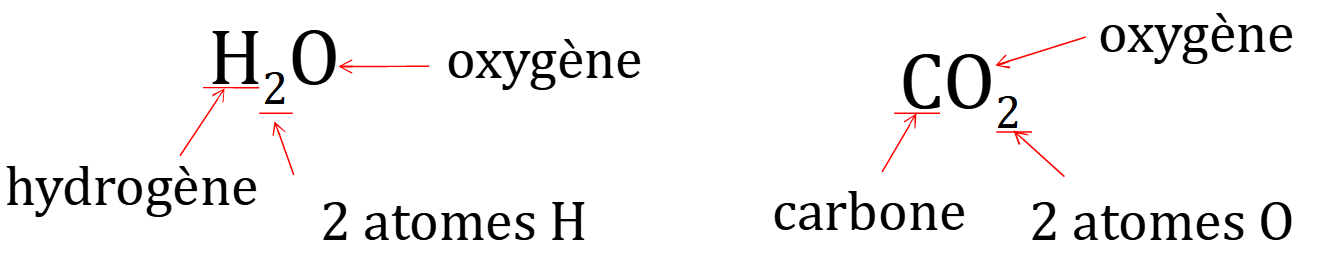
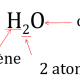
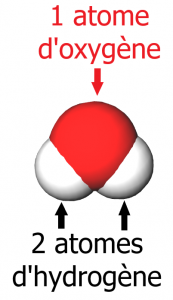
La molécule d’eau, H2O, est composée de 2 atomes d’hydrogène et d’un atome d’oxygène.
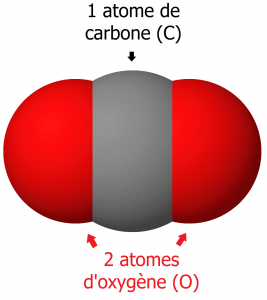
La molécule de dioxyde de carbone,CO2, est composée de 2 atomes d’oxygène et d’un atome de carbone.
La liste des molécules à connaître (par cœur):
- CH4: méthane
- H2O: eau
- O2: dioxygène
- H2: dihydrogène
- CO2: dioxyde de carbone
- N2O: protoxyde d'azote
dihydrogène

Dioxygène

diazote

méthane
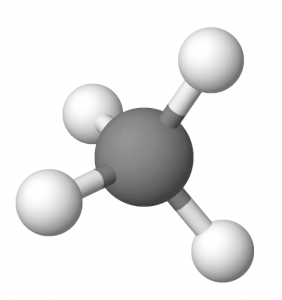
protoxyde d'azote

III. LA TRANSFORMATION ET LA REACTION CHIMIQUE
A. Définitions
Système chimique
Le système chimique est l'ensemble des espèces chimiques auxquelles on s'intéresse.
Lors d'une combustion, le système chimique est constitué :
- Du combustible
- Du dioxygène
- Des différents produits
Transformation chimique
Une transformation chimique est la modification d'un système chimique, évoluant d'un état initial à un état final.
Une combustion est une transformation chimique, puisque l'état initial du système diffère de son état final.
Réactif
Un réactif est une espèce chimique consommée lors d'une transformation chimique.
Lors de la combustion du carbone dans le dioxygène, le carbone et le dioxygène sont des réactifs.
Produit
Un produit est une espèce chimique formée lors d'une transformation chimique.
Lors de la combustion du carbone dans le dioxygène, le dioxyde de carbone est un produit.
Réaction chimique
La réaction chimique est la modélisation, à l'échelle macroscopique, d'une transformation chimique en un processus unique :
Réactifs → Produits
Équation de la réaction chimique
L'équation de la réaction chimique est l'écriture symbolique de la réaction. Les espèces chimiques sont représentées par leurs formules chimiques, les réactifs placés à gauche et les produits à droite d'une flèche qui représente le sens d'évolution du système.
L'équation chimique de la combustion du carbone est :
C(s) + O2(g) → CO2(g)
Dans l'équation de la réaction chimique, la flèche se lit "donne".
B. Les réactions équilibrées: l’exemple de la combustion complète du carbone
On a déjà vu que le bilan de la combustion du carbone est :
carbone + dioxygène → dioxyde de carbone
Soit, en utilisant les symboles, puis les modèles des atomes et des molécules :

C(s) + O2 (g) → CO2(g)
Il y a autant d'atomes de carbone et d'oxygène au début et à la fin de la transformation chimique, on dit que la réaction est équilibrée.
Réaction équilibrée
Une réaction chimique doit être équilibrée : tous les atomes présents du côté des réactifs doivent être présents du côté des produits et inversement.
C. Les réactions équilibrées: l’exemple de la combustion du méthane
On a déjà vu que le bilan de la combustion complète du méthane est :
méthane + dioxygène dioxyde de carbone + eau
Soit, en utilisant les symboles, puis les modèles des atomes et des molécules :

CH4(g) + O2(g) → H2O(g) + CO2(g)
Pour équilibrer la réaction, on ajuste ses coefficients stœchiométriques.
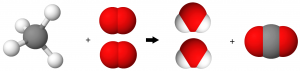
CH4(g) + 2 O2(g) → 2 H2O(g) + CO2(g)
Bilan: Réactifs: 1 C, 4 H et 4O → Produits: 1 C, 4H et 4O
La réaction est équilibrée.
Coefficients stœchiométriques
Les coefficients stœchiométriques sont les nombres placés devant les espèces chimiques dans l'équation d'une réaction chimique. Le nombre "1" n'est pas écrit.
Dans l'équation de la combustion du glucose : C6H12O6(s) + 6 O2(g) →6 CO2(g) + 6 H2O(g)
Les coefficients stœchiométriques sont :
1 pour le glucose C6H12O6
6 pour le dioxygène O2, le dioxyde carbone CO2 et l'eau H2O
On modifie donc les coefficients stœchiométriques des espèces permettant d'équilibrer un des atomes de la réaction.
Souvent, il vaut mieux terminer par l'atome d'oxygène, car il est commun à plusieurs espèces chimiques.
IV. LA CONSERVATION DE LA MASSE LORS DE LA RÉACTION CHIMIQUE
Une transformation chimique est une réorganisation des atomes présents dans les réactifs. Il n'y a donc pas de perte de la matière entre le début de la transformation et la fin.
Conservation de la masse
Au cours d'une transformation chimique, la masse des réactifs qui disparaît est égale à la masse des produits qui se forment : la masse se conserve.
Lors de la combustion du carbone dans le dioxygène, si 11 g de carbone C et 8 g de dioxygène O2 sont consommés, il se forme alors 11 + 8 = 19 g de dioxyde de carbone CO2.